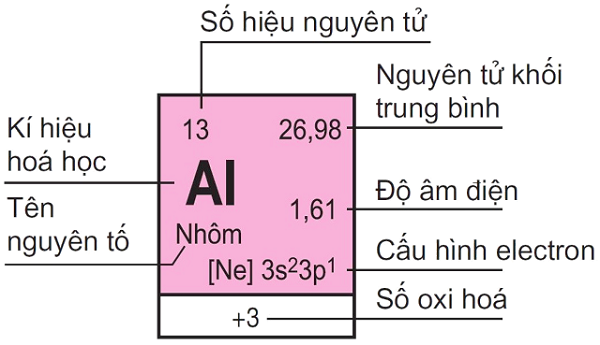
Trả lời:
-
Số hiệu nguyên tử của một nguyên tố là số đơn vị điện tích hạt nhân của nguyên tử thuộc nguyên tố đó, được ký hiệu là Z.
-
Cách xác định số hiệu nguyên tử:
Công thức: Z = P = ETrong đó:
- Z: Số hiệu nguyên tử
- P: Tổng số proton trong hạt nhân nguyên tử
- E: Tổng số electron trong nguyên tử
-
Ví dụ: Nguyên tử natri có 11 proton và 12 nơtron. Do đó, số hiệu nguyên tử của natri là:
Z = P = 11.

1. Số Hiệu Nguyên Tử Là Gì?
Số hiệu nguyên tử (kí hiệu là Z) là số lượng proton có trong hạt nhân của một nguyên tử. Đây là đại lượng đặc trưng cho từng nguyên tố hóa học và cũng chính là số thứ tự của nguyên tố đó trong bảng tuần hoàn.
Ví dụ:
- Nguyên tử hydro có Z = 1, nghĩa là trong hạt nhân của nguyên tử hydro có 1 proton.
- Nguyên tử oxy có Z = 8, tức là chứa 8 proton trong hạt nhân.
Số hiệu nguyên tử không chỉ giúp xác định một nguyên tố mà còn quyết định số electron của nguyên tử trung hòa về điện, từ đó ảnh hưởng đến tính chất hóa học của nguyên tố đó.
2. Cách Xác Định Số Hiệu Nguyên Tử
Có nhiều cách để xác định số hiệu nguyên tử của một nguyên tố, bao gồm:
2.1. Dựa vào bảng tuần hoàn hóa học
Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần của số hiệu nguyên tử. Do đó, chỉ cần tra cứu nguyên tố trong bảng tuần hoàn là có thể xác định được số hiệu nguyên tử của nó.
Ví dụ:
- Natri (Na) có số hiệu nguyên tử Z = 11.
- Lưu huỳnh (S) có số hiệu nguyên tử Z = 16.
2.2. Dựa vào số proton trong hạt nhân
Số hiệu nguyên tử Z chính là số lượng proton trong hạt nhân nguyên tử của nguyên tố đó. Nếu biết số proton, ta xác định được ngay số hiệu nguyên tử.
Ví dụ:
- Nguyên tử có 17 proton → Số hiệu nguyên tử Z = 17 → Nguyên tố Clo (Cl).
- Nguyên tử có 20 proton → Số hiệu nguyên tử Z = 20 → Nguyên tố Canxi (Ca).
2.3. Dựa vào kí hiệu nguyên tử
Công thức tổng quát của một nguyên tử:
AZX_A^Z X

Trong đó:
- X là ký hiệu nguyên tố.
- A là số khối (tổng số proton và neutron).
- Z là số hiệu nguyên tử (cũng chính là số proton).
Ví dụ:
1123Na^{23}_{11}Na
- Z = 11 → Natri (Na) có số hiệu nguyên tử 11.
2.4. Dựa vào cấu hình electron
Số hiệu nguyên tử cũng chính là tổng số electron của một nguyên tử trung hòa về điện. Nếu biết cấu hình electron, ta có thể xác định số electron, từ đó suy ra số hiệu nguyên tử.
Ví dụ:
- Cấu hình electron của oxy (O): 1s² 2s² 2p⁴ → Tổng số electron = 8 → Số hiệu nguyên tử Z = 8.
- Cấu hình electron của nhôm (Al): 1s² 2s² 2p⁶ 3s² 3p¹ → Tổng số electron = 13 → Số hiệu nguyên tử Z = 13.
Nguồn Gốc Của Số Hiệu Nguyên Tử
Số hiệu nguyên tử (Z) có nguồn gốc từ sự nghiên cứu về cấu tạo nguyên tử và sự phát triển của bảng tuần hoàn các nguyên tố hóa học. Dưới đây là những cột mốc quan trọng liên quan đến sự ra đời và ý nghĩa của số hiệu nguyên tử.
1. Khái Niệm Ban Đầu Về Nguyên Tố Hóa Học
Trước thế kỷ 19, các nhà khoa học đã biết đến một số nguyên tố hóa học nhưng chưa có cách sắp xếp chúng một cách hệ thống. Nhiều giả thuyết được đưa ra để phân loại các nguyên tố dựa trên khối lượng nguyên tử và tính chất hóa học.
2. Bảng Tuần Hoàn Của Mendeleev (1869)
Nhà hóa học người Nga Dmitri Mendeleev là người đầu tiên sắp xếp các nguyên tố vào bảng tuần hoàn dựa trên khối lượng nguyên tử và tính chất hóa học của chúng. Tuy nhiên, bảng tuần hoàn của Mendeleev vẫn chưa hoàn thiện, và có những nguyên tố chưa được phát hiện hoặc sắp xếp chưa chính xác.
3. Phát Minh Số Hiệu Nguyên Tử (1913) – Henry Moseley
Vào năm 1913, nhà vật lý người Anh Henry Moseley đã tiến hành nghiên cứu về tia X phát ra từ các nguyên tố khác nhau. Ông phát hiện rằng tần số của tia X tỷ lệ thuận với một giá trị nguyên số đặc trưng cho từng nguyên tố. Giá trị này chính là số lượng proton trong hạt nhân, mà ngày nay gọi là số hiệu nguyên tử (Z).
4. Ý Nghĩa Của Phát Hiện Moseley
Phát hiện của Moseley đã giúp khẳng định rằng:
- Số hiệu nguyên tử (Z) là đặc trưng duy nhất của một nguyên tố, chứ không phải khối lượng nguyên tử như Mendeleev từng đề xuất.
- Các nguyên tố trong bảng tuần hoàn nên được sắp xếp theo số hiệu nguyên tử thay vì khối lượng nguyên tử.
- Những vị trí còn trống trong bảng tuần hoàn có thể dự đoán chính xác dựa trên số hiệu nguyên tử.
Ví dụ: Moseley dự đoán sự tồn tại của các nguyên tố chưa được biết đến tại thời điểm đó, như Technetium (Z = 43), Rhenium (Z = 75), Hafnium (Z = 72), và sau này chúng đã được tìm thấy đúng theo dự đoán.
Bảng số hiệu nguyên tử?
| Số hiệu nguyên tử | Viết tắt | Khối lượng nguyên tử |
| 1 | H | 1.00797 |
| 2 | He | 4.0026 |
| 3 | Li | 6.941 |
| 4 | Be | 9.01218 |
| 5 | B | 10.81 |
| 6 | C | 12.011 |
| 7 | N | 14.0067 |
| 8 | O | 15.9994 |
| 9 | F | 18.9984 |
| 10 | Ne | 20.179 |
| 11 | Na | 22.98977 |
| 12 | Mg | 24.305 |
| 13 | Al | 26.98154 |
| 14 | Si | 28.0855 |
| 15 | P | 30.97376 |
| 16 | S | 32.06 |
| 17 | Cl | 35.453 |
| 18 | Ar | 39.948 |
| 19 | K | 39.0983 |
| 20 | Ca | 40.08 |
| 21 | Sc | 44.9559 |
| 22 | Ti | 47.9 |
| 23 | V | 50.9415 |
| 24 | Cr | 51.996 |
| 25 | Mn | 54.938 |
| 26 | Fe | 55.847 |
| 27 | Co | 58.9332 |
| 28 | Ni | 58.7 |
| 29 | Cu | 63.546 |
| 30 | Zn | 65.38 |
| 31 | Ga | 69.72 |
| 32 | Ge | 72.59 |
| 33 | As | 74.9216 |
| 34 | Se | 78.96 |
| 35 | Br | 79.904 |
| 36 | Kr | 83.8 |
| 37 | Rb | 85.4678 |
| 38 | Sr | 87.62 |
| 39 | Y | 88.9059 |
| 40 | Zr | 91.22 |
| 41 | Nb | 92.9064 |
| 42 | Mo | 95.94 |
| 43 | Tc | -98 |
| 44 | Ru | 101.07 |
| 45 | Rh | 102.9055 |
| 46 | Pd | 106.4 |
| 47 | Ag | 107.868 |
| 48 | Cd | 112.41 |
| 49 | In | 114.82 |
| 50 | Sn | 118.69 |
| 51 | Sb | 121.75 |
| 52 | Te | 127.6 |
| 53 | I | 126.9045 |
| 54 | Xe | 131.3 |
| 55 | Cs | 132.9054 |
| 56 | Ba | 137.33 |
| 57 | La | 138.9055 |
| 58 | Ce | 140.12 |
| 59 | Pr | 140.9077 |
| 60 | Nd | 144.24 |
| 61 | Pm | -145 |
| 62 | Sm | 150.4 |
| 63 | Eu | 151.96 |
| 64 | Gd | 157.25 |
| 65 | Tb | 158.9254 |
| 66 | Dy | 162.5 |
| 67 | Ho | 164.9304 |
| 68 | Er | 167.26 |
| 69 | Tm | 168.9342 |
| 70 | Yb | 173.04 |
| 71 | Lu | 174.967 |
| 72 | Hf | 178.49 |
| 73 | Ta | 180.9479 |
| 74 | W | 183.85 |
| 75 | Re | 186.207 |
| 76 | Os | 190.2 |
| 77 | Ir | 192.22 |
| 78 | Pt | 195.09 |
| 79 | Au | 196.9665 |
| 80 | Hg | 200.59 |
| 81 | Tl | 204.37 |
| 82 | Pb | 207.2 |
| 83 | Bi | 208.9804 |
| 84 | Po | -209 |
| 85 | At | -210 |
| 86 | Rn | -222 |
| 87 | Fr | -223 |
| 88 | Ra | 226.0254 |
| 89 | Ac | 227.0278 |
| 90 | Th | 232.0381 |
| 91 | Pa | 231.0359 |
| 92 | U | 238.029 |
| 93 | Np | 237.0482 |
| 94 | Pu | -242 |
| 95 | Am | -243 |
| 96 | Cm | -247 |
| 97 | Bk | -247 |
| 98 | Cf | -251 |
| 99 | Es | -252 |
| 100 | Fm | -257 |
| 101 | Md | -258 |
| 102 | No | -250 |
| 103 | Lr | -260 |
| 104 | Rf | -261 |
| 105 | Db | -262 |
| 106 | Sg | -263 |
| 107 | Bh | -262 |
| 108 | Hs | -255 |
| 109 | Mt | -256 |
| 110 | Ds | -269 |
| 111 | Rg | -272 |
| 112 | Uub | -277 |
| 113 | — | ——— |
| 114 | Uuq |
3. Kết Luận
Số hiệu nguyên tử là một thông số quan trọng giúp xác định nguyên tố hóa học, vị trí trong bảng tuần hoàn, cũng như tính chất hóa học của nguyên tố. Việc hiểu và xác định số hiệu nguyên tử sẽ giúp học sinh dễ dàng nắm vững kiến thức hóa học và áp dụng hiệu quả vào việc giải bài tập.