Lý thuyết Hóa học 8 Bài 15: Định luật bảo toàn khối lượng
1. Định Luật Bảo Toàn Khối Lượng Là Gì?

Còn được biết đến với tên gọi định luật Lomonosov – Lavoisier,
- Định luật bảo toàn khối lượng do hai nhà khoa học Lo-mô-nô-xốp (Nga, 1711-1765) và La-voa-diê (Pháp, 1743-1794) phát hiện.
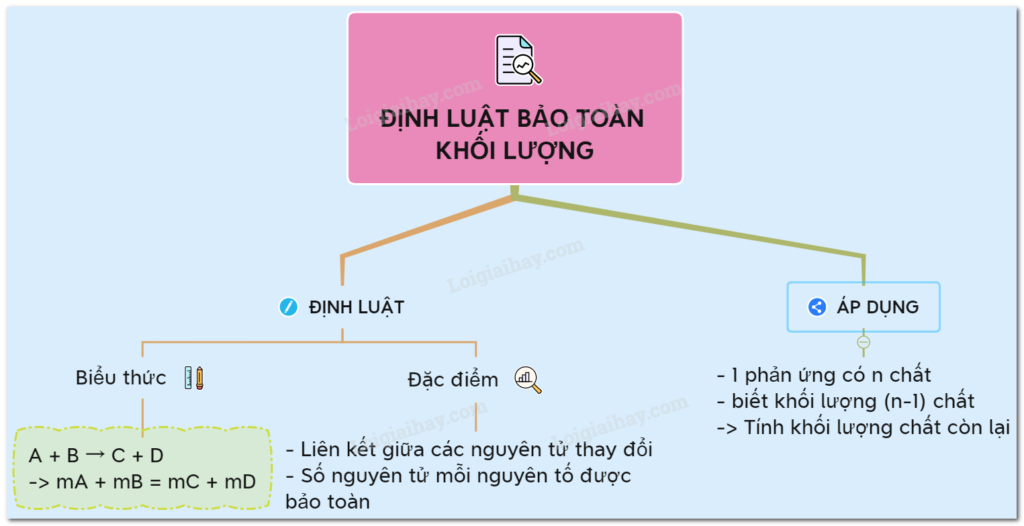
“Trong mỗi phản ứng hóa học, tổng khối lượng các chất tham gia phản ứng luôn bằng tổng khối lượng các sản phẩm tạo thành.”
Ý Nghĩa Quan Trọng
- Định luật này giúp xác định khối lượng của các chất trong phản ứng, để từ đó tính toán chính xác hơn trong các bài tập hóa học.
- Giúp dự báo lượng chất cần thiết khi tham gia hoặc tạo thành trong một phản ứng.
Ví dụ áp dụng
Định luật bảo toàn khối lượng giúp ta tính khối lượng của một chất khi biết khối lượng của các chất còn lại trong phản ứng.
Ví dụ: Cho 4g NaOH tác dụng với 8g CuSO₄, thu được 4,9g kết tủa Cu(OH)₂ và muối Na₂SO₄. Hãy tính khối lượng Na₂SO₄.
Áp dụng định luật bảo toàn khối lượng:
mNaOH+mCuSO4=mCu(OH)2+mNa2SO4m_{NaOH} + m_{CuSO₄} = m_{Cu(OH)₂} + m_{Na₂SO₄}
Thay số vào:
4g+8g=4,9g+mNa2SO44g + 8g = 4,9g + m_{Na₂SO₄}
Suy ra:
mNa2SO4=7,1gm_{Na₂SO₄} = 7,1g

Định luật bảo toàn khối lượng là một trong những nguyên lý cốt lõi trong hóa học, giúp cố định khối lượng trong các phản ứng hóa học. Hiểu rõ về định luật này không chỉ giúp bạn dễ dàng giải bài tập mà còn đặt nền tảng vững chắc cho việc nghiên cứu hóa học sau này.
Theo dõi Banghoatri.edu.vn – Hệ thống kiến thức hóa học đầy đủ, chi tiết
2. Công Thức Định Luật Bảo Toàn Khối Lượng
Công thức chung:
Trong đó:
- là khối lượng các chất tham gia phản ứng
- là khối lượng các sản phẩm tạo thành
Ví dụ: Phản ứng giữa bari clorua và natri sunphat:
Nguyên tắc: Biết khối lượng của chất, ta hoàn toàn có thể tính được khối lượng của chất còn lại.