Liên kết cộng hóa trị (LKCHT) là liên kết giữa hai nguyên tử hoặc ion, trong đó các cặp electron (e) được chia sẻ chung. Đây còn được gọi là liên kết phân tử và thường hình thành giữa các nguyên tử phi kim có độ âm điện tương đương hoặc gần nhau.
Liên kết cộng hóa trị xuất hiện phổ biến trong nhiều hợp chất hóa học, bao gồm các gốc tự do và đại phân tử. Thuật ngữ này được sử dụng lần đầu vào năm 1939, mặc dù từ năm 1919, nhà khoa học Irving Langmuir đã đề xuất khái niệm “cộng hóa trị” để mô tả sự chia sẻ electron giữa các nguyên tử lân cận.
Các hợp chất có LKCHT có thể tồn tại ở trạng thái khí, lỏng hoặc rắn. Mỗi cặp electron được chia sẻ giữa hai nguyên tử được gọi là cặp liên kết, trong khi các electron không tham gia liên kết được gọi là cặp đơn độc.
1. Liên kết cộng hóa trị là gì?
Liên kết cộng hóa trị là liên kết hình thành giữa hai nguyên tử bởi một hoặc nhiều cặp electron dùng chung. Mỗi cặp electron được chia sẻ giữa hai nguyên tử gọi là cặp liên kết; nếu không được chia sẻ, chúng gọi là cặp đơn độc. Việc dùng chung electron giúp mỗi nguyên tử đạt được cấu hình electron bền vững.

2. Sự tạo thành liên kết cộng hóa trị trong phân tử đơn chất
Sự hình thành phân tử Hydro (H₂)
- Nguyên tử H có cấu hình electron 1s¹. Mỗi nguyên tử H góp một electron để tạo thành một cặp electron chung, hình thành liên kết giữa hai nguyên tử H.
- Công thức electron: H : H
- Công thức cấu tạo: H–H
Sự hình thành phân tử Nitơ (N₂)
- Nguyên tử N có cấu hình electron 1s² 2s² 2p³, với 5 electron ở lớp ngoài cùng. Trong phân tử N₂, mỗi nguyên tử N góp chung 3 electron để đạt cấu hình bền vững của neon.
- Công thức electron: :N:::N:
- Công thức cấu tạo: N≡N
3. Sự tạo thành liên kết cộng hóa trị trong phân tử hợp chất
Sự hình thành phân tử Hydro Clorua (HCl)

- Trong phân tử HCl, nguyên tử H và Cl mỗi bên góp một electron để tạo thành một cặp electron dùng chung.
- Công thức electron: H :Cl
- Công thức cấu tạo: H–Cl
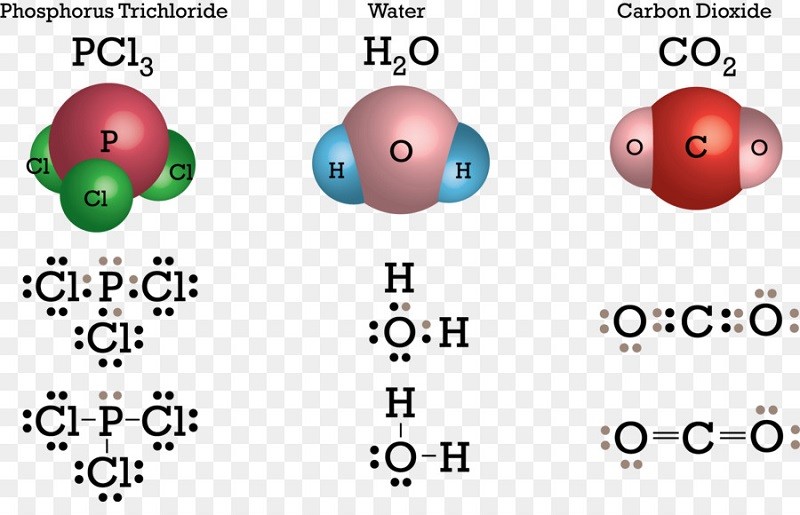
Sự hình thành phân tử Cacbon Dioxit (CO₂)
- Trong CO₂, nguyên tử C ở giữa hai nguyên tử O, mỗi nguyên tử C góp chung 2 electron với mỗi nguyên tử O, tạo nên hai liên kết đôi.
- Công thức electron: :O::C::O:
- Công thức cấu tạo: O=C=O
4. Phân loại liên kết cộng hóa trị
Liên kết cộng hóa trị không phân cực
- Khi hai nguyên tử tham gia liên kết có độ âm điện bằng nhau hoặc chênh lệch không đáng kể.
- Ví dụ:
- Phân tử O₂:
O + O → O₂ - Phân tử N₂:
N + N → N₂
- Phân tử O₂:
- Ví dụ:
Liên kết cộng hóa trị có phân cực
- Khi hai nguyên tử có độ âm điện chênh lệch nhau rõ rệt.
- Ví dụ:
- Phân tử nước (H₂O):
H₂ + O → H₂O - Phân tử Amoniac (NH₃):
N + 3H → NH₃ - Phân tử Hydro Clorua (HCl):
H + Cl → HCl
- Phân tử nước (H₂O):
- Ví dụ:
5. Tính chất của các chất có liên kết cộng hóa trị

Trạng thái tồn tại
- Các chất có liên kết cộng hóa trị có thể tồn tại ở cả ba trạng thái: rắn, lỏng và khí.
Tính chất vật lý
- Nhiệt độ nóng chảy và sôi: Thường thấp hơn so với các hợp chất ion.
- Tính dẫn điện: Không dẫn điện ở trạng thái rắn, nhưng một số chất có thể dẫn điện khi tan trong dung môi thích hợp.
- Tính tan: Các chất không phân cực thường không tan trong nước, còn các chất phân cực có thể tan tốt.
- Ví dụ:
- O₂ không tan trong nước.
- HCl tan tốt trong nước:
HCl → H⁺ + Cl⁻
- Ví dụ:
6. Hiệu độ âm điện và liên kết hóa học
- Hiệu độ âm điện (ΔEN):
- Nếu ΔEN < 0,4: Liên kết không phân cực.
- Nếu 0,4 ≤ ΔEN < 1,7: Liên kết phân cực.
- Nếu ΔEN ≥ 1,7: Liên kết ion.
7. Kết luận
Liên kết cộng hóa trị là một dạng liên kết hóa học quan trọng, giúp hình thành và ổn định các phân tử trong tự nhiên. Việc hiểu rõ loại liên kết này giúp giải thích các tính chất và ứng dụng của các chất trong hóa học.