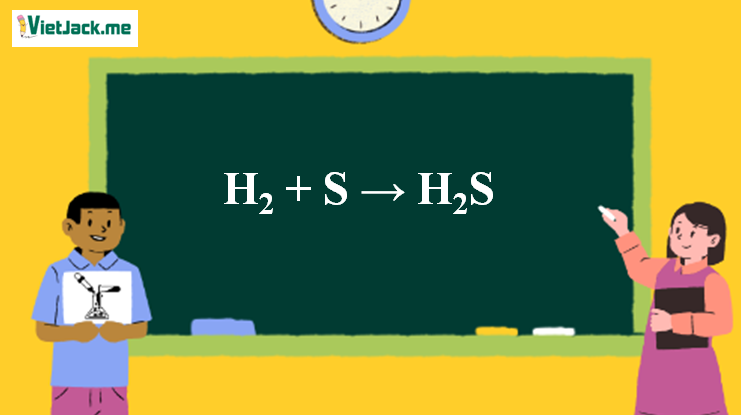1. Giới thiệu về phản ứng
Phản ứng giữa khí hydro (H₂) và lưu huỳnh (S) tạo ra hydro sulfua (H₂S) là một phản ứng hóa hợp, trong đó hai chất đơn giản kết hợp với nhau tạo thành một hợp chất mới. Phản ứng Hóa Học khi ta kết hợp H2 với S thu được một hợp chất khí vô cơ không màu, có mùi hắc hoặc mùi trứng thối rất đặc trưng để nhận biết phản ứng Hóa Học

Chất tham gia
- H₂ (Khí hydro): Là một chất khí không màu, không mùi và nhẹ hơn không khí.
- S (Lưu huỳnh): Ở trạng thái rắn, có màu vàng chanh.
Chất sản phẩm
- H₂S (Hydro sulfua): Là một chất khí không màu, có mùi hắc đặc trưng giống mùi trứng thối, rất độc.
2. Đặc điểm của khí H₂S
Hydro sulfua (H₂S) là một hợp chất hóa học có tính chất đặc biệt:
- Ở điều kiện thường, H₂S là một chất khí có mùi hắc, khó chịu.
- Tan trong nước tạo thành dung dịch axit sunfuhidric (H₂S), là một axit yếu.
- H₂S khác với axit sunfuric (H₂SO₄), vì H₂SO₄ là một axit mạnh.
- Rất độc, có thể gây ngộ độc nếu hít phải ở nồng độ cao.
3. Tính chất hóa học của H₂S
3.1. Tính axit của H₂S
H₂S tan trong nước tạo thành axit sunfuhidric, có tính axit yếu hơn cả axit cacbonic (H₂CO₃). Phương trình ion của sự phân ly:
- H₂S → H⁺ + HS⁻ (hằng số ion hóa K₁ = 6 × 10⁻⁸)
- HS⁻ → H⁺ + S²⁻ (hằng số ion hóa K₂ = 10⁻¹⁴)
3.2. Phản ứng với dung dịch kiềm
H₂S tác dụng với dung dịch kiềm tạo hai loại muối: muối trung hòa và muối axit.
- H₂S + Ba(OH)₂ → BaS + H₂O (muối trung hòa)
- H₂S + Ca(OH)₂ → Ca(HS)₂ + H₂O (muối axit)
- H₂S + Ca(OH)₂ → CaS + H₂O (muối trung hòa, tạo kết tủa CaS)
- H₂S + K₂CO₃ → KHCO₃ + KHS (muối hiđro cacbonat)
3.3. Tính khử của H₂S
Trong các phản ứng oxi hóa – khử, H₂S đóng vai trò là chất khử mạnh vì lưu huỳnh trong hợp chất này có số oxi hóa -2 (mức oxi hóa thấp nhất của lưu huỳnh). Một số phản ứng điển hình:
Phản ứng với oxi:

- 2H₂S + O₂ → 2H₂O + 2S (thiếu oxi, xảy ra ở nhiệt độ thấp)
- 2H₂S + 3O₂ → 2H₂O + 2SO₂ (dư oxi, xảy ra ở nhiệt độ cao)
Phản ứng với chất oxi hóa mạnh:
- H₂S + 4Br₂ + 4H₂O → H₂SO₄ + 8HBr
- H₂S + 8HNO₃ (đặc) → H₂SO₄ + 8NO₂ + 4H₂O
- H₂S + H₂SO₄ (đặc) → S + SO₂ + 2H₂O
4. Điều chế khí H₂S

Khí H₂S có thể được điều chế bằng cách cho luồng khí H₂ đi qua bột lưu huỳnh đun nóng:
- S + H₂ → H₂S (nhiệt độ cao, không cần xúc tác)
Sau khi điều chế, khí H₂S thường được dẫn qua dung dịch kiềm như KOH, NaOH hoặc Ba(OH)₂ để hấp thụ, tránh gây độc cho môi trường.
5. Ví dụ và bài tập minh họa
Ví dụ 1:
Cho 3,2 gam lưu huỳnh tác dụng với khí hydro dư, tính khối lượng H₂S tạo thành.
Giải:
- Số mol của lưu huỳnh: n(S) = 3,2 / 32 = 0,1 mol
- Phương trình phản ứng: H₂ + S → H₂S
- Theo phương trình, 1 mol S tạo ra 1 mol H₂S, vậy 0,1 mol S sẽ tạo ra 0,1 mol H₂S.
- Khối lượng H₂S tạo thành: m(H₂S) = 0,1 × 34 = 3,4 gam.
Đáp số: 3,4 gam.
Bài tập:
- Tính thể tích khí H₂ (ở điều kiện tiêu chuẩn) cần để phản ứng hoàn toàn với 16 gam lưu huỳnh.
- Viết phương trình hóa học của phản ứng giữa H₂S với:
- Dung dịch NaOH dư.
- Dung dịch HNO₃ đặc.
- Khi đốt cháy H₂S trong không khí với lượng oxi dư, sản phẩm thu được là gì? Viết phương trình phản ứng.
6. Kết luận
Phản ứng H₂ + S → H₂S là một phản ứng hóa hợp quan trọng. H₂S có nhiều tính chất hóa học đặc biệt như tính axit yếu, tính khử mạnh và khả năng tạo muối với dung dịch kiềm. Tuy nhiên, do tính độc của khí này, cần cẩn trọng khi làm thí nghiệm hoặc ứng dụng trong công nghiệp.
Banghoatri.edu.vn được tạo ra với sứ mệnh hỗ trợ người dùng tra cứu bảng hóa trị của nguyên tử và phân tử một cách nhanh chóng, chính xác và tiện lợi.