BẢNG HÓA TRỊ CÁC NGUYÊN TỐ HÓA HỌC
Hóa trị của các nguyên tố là một trong những thông số quan trọng mà học sinh, sinh viên cần ghi nhớ. Đây là kiến thức nền tảng để viết phương trình hóa học và giải các bài tập tự luận hoặc trắc nghiệm.
Việc nắm vững bảng hóa trị giúp học sinh củng cố kiến thức và áp dụng hiệu quả vào bài tập. Dưới đây là nội dung chi tiết, mời các bạn tham khảo và tải Bảng hóa trị các nguyên tố hóa học.
I. Hóa Trị Là Gì?
Hóa trị là số liên kết hóa học mà một nguyên tử có thể tạo ra với nguyên tử khác. Hóa trị thường được xác định dựa trên số electron lớp ngoài cùng hoặc khả năng kết hợp của nguyên tố với hydro hoặc oxy.
Bảng hóa trị là bảng tổng hợp các nguyên tố hóa học cơ bản cùng với hóa trị của chúng. Việc ghi nhớ bảng hóa trị giúp học sinh giải quyết các bài tập hóa học một cách chính xác và hiệu quả.
Lưu ý: Một số nguyên tố chỉ có một hóa trị cố định, trong khi những nguyên tố khác có thể mang nhiều hóa trị khác nhau tùy thuộc vào điều kiện phản ứng.
II. Bảng Hóa Trị Các Nguyên Tố Hóa Học
Dưới đây là một số nguyên tố phổ biến cùng hóa trị của chúng:
Các nguyên tố trong bảng hóa trị được sắp xếp theo thứ tự tăng dần của số proton.
| Số proton | Tên Nguyên tố | Ký hiệu hoá học | Nguyên tử khối | Hoá trị |
| 1 | Hiđro | H | 1 | I |
| 2 | Heli | He | 4 | |
| 3 | Liti | Li | 7 | I |
| 4 | Beri | Be | 9 | II |
| 5 | Bo | B | 11 | III |
| 6 | Cacbon | C | 12 | IV, II |
| 7 | Nitơ | N | 14 | II, III, IV… |
| 8 | Oxi | O | 16 | II |
| 9 | Flo | F | 19 | I |
| 10 | Neon | Ne | 20 | |
| 11 | Natri | Na | 23 | I |
| 12 | Magie | Mg | 24 | II |
| 13 | Nhôm | Al | 27 | III |
| 14 | Silic | Si | 28 | IV |
| 15 | Photpho | P | 31 | III, V |
| 16 | Lưu huỳnh | S | 32 | II, IV, VI |
| 17 | Clo | Cl | 35,5 | I,… |
| 18 | Argon | Ar | 39,9 | |
| 19 | Kali | K | 39 | I |
| 20 | Canxi | Ca | 40 | II |
| 24 | Crom | Cr | 52 | II, III |
| 25 | Mangan | Mn | 55 | II, IV, VII… |
| 26 | Sắt | Fe | 56 | II, III |
| 29 | Đồng | Cu | 64 | I, II |
| 30 | Kẽm | Zn | 65 | II |
| 35 | Brom | Br | 80 | I… |
| 47 | Bạc | Ag | 108 | I |
| 56 | Bari | Ba | 137 | II |
| 80 | Thuỷ ngân | Hg | 201 | I, II |
| 82 | Chì | Pb | 207 | II, IV |
Chú thích:
– Nguyên tố phi kim: chữ màu xanh
– Nguyên tố kim loại: chữ màu đen
– Nguyên tố khí hiếm: chữ màu đỏ
Ngoài ra, học sinh có thể xác định hóa trị dựa vào bảng tuần hoàn các nguyên tố hóa học như sau:
Bảng tuần hoàn hóa học dành cho học sinh lớp 8:

Bảng tuần hoàn các nguyên tố hóa học cho học sinh lớp 9:

Bảng tuần hoàn nguyên tố hóa học lớp 10 như sau:

Bảng hóa trị của một số nhóm nguyên tử
| Tên nhóm | Ký hiệu | Hóa trị |
|---|---|---|
| Nitrat | Cl | I |
| Hidroxit | NO3 | I |
| Sunfat | OH | I |
| Sunfit | SO4 | II |
| Cacbonat | SO3 | II |
| Photphat | PO4 | III |
Bảng hóa trị nhóm đơn giản
1. Cách Xác Định Hóa Trị
- Dựa vào bảng tuần hoàn hóa học: Các nguyên tố thuộc nhóm IA có hóa trị I, nhóm IIA có hóa trị II, nhóm IIIA có hóa trị III…
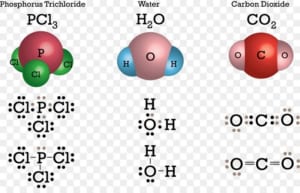
- Dựa vào công thức hợp chất: Tổng hóa trị của các nguyên tố trong một hợp chất luôn bằng 0. Ví dụ:
- Trong H₂O: Oxi có hóa trị II → Hiđro có hóa trị I.
- Trong Fe₂O₃: Oxi hóa trị II → Sắt có hóa trị III.
2. Cách bước xác định hóa trị nguyên tử
Bước 1: Viết công thức dạng AxBy
Bước 2: Đặt đẳng thức: x hóa trị của A = y × hóa trị của B
Bước 3: Chuyển đổi thành tỉ lệ: ![]() xy=ba=bʹaʹ = Hóa tri của B/Hóa trị của A
xy=ba=bʹaʹ = Hóa tri của B/Hóa trị của A
Chọn a’, b’ là những số nguyên dương và tỉ lệ b’/a’ là tối giản => x = b (hoặc b’); y = a (hoặc a’)
Ví dụ: Lập công thức hóa học của hợp chất sau: C (IV) và S (II)
Bước 1: Công thức hóa học của C (IV) và S (II) có dạng ![]() CVIxSIIy
CVIxSIIy
Bước 2: Biểu thức quy tắc hóa trị: x.IV = y.II
Chuyển thành tỉ lệ:
![]() xy=IIIV=24=12>x=1;y=2
xy=IIIV=24=12>x=1;y=2
Bước 3: Công thức hóa học cần tìm là: CS2
2.Ý Nghĩa Và Ứng Dụng Của Hóa Trị
- Giúp viết đúng công thức hóa học của các hợp chất.
- Dự đoán phản ứng hóa học, giúp học sinh hiểu cách các nguyên tố kết hợp với nhau.
- Ứng dụng trong đời sống và sản xuất, như chế tạo hợp chất trong công nghiệp dược phẩm, luyện kim, môi trường.
III. Bài Ca Hóa Trị Dễ Nhớ cho học sinh
1. Bài ca hóa trị số 1 cơ bản.
Kali, Iôt, Hiđro
Natri với bạc, Clo một loài
Có hóa trị 1 bạn ơi
Nhớ ghi cho rõ kẻo rồi phân vân
Magiê, chì, Kẽm, thủy ngân
Canxi, Đồng ấy cũng gần Bari
Cuối cùng thêm chú Oxi
Hóa trị 2 ấy có gì khó khăn
Bác Nhôm hóa trị 3 lần
Ghi sâu trí nhớ khi cần có ngay
Cacbon, Silic này đây
Là hóa trị 4 không ngày nào quên
Sắt kia kể cũng quen tên
2, 3 lên xuống thật phiền lắm thay
Nitơ rắc rối nhất đời
1, 2, 3, 4 khi thời thứ 5
Lưu huỳnh lắm lúc chơi khăm
Xuống 2, lên 6 khi nằm thứ 4
Photpho nói tới không dư
Nếu ai hỏi đến thì hừ rằng 5
Em ơi cố gắng học chăm
Bài ca hóa trị suốt năm rất cần
2. Bài ca hóa trị số 2 chi tiết.
Hidro (H) cùng với liti (Li)
Natri (Na) cùng với kali (K) chẳng rời Ngoài ra còn bạc (Ag) sáng ngời
Chỉ mang hoá trị I thôi chớ nhầm
Riêng đồng (Cu) cùng với thuỷ ngân (Hg)
Thường II ít I chớ phân vân gì
Đổi thay II , IV là chì (Pb)
Điển hình hoá trị của chì là II
Bao giờ cùng hoá trị II
Là ôxi (O) , kẽm(Zn) chẳng sai chút gì
Ngoài ra còn có canxi (Ca)
Magiê (Mg) cùng với bari (Ba) một nhà
Bo (B) , nhôm (Al) thì hóa trị III
Cácbon C Silic (Si) thiếc (Sn) là IV thôi
Thế nhưng phải nói thêm lời
Hóa trị II vẫn là nơi đi về
Sắt (Fe) II toan tính bộn bề
Không bền nên dễ biến liền sắt III
Phốtpho III ít gặp mà
Photpho V chính người ta gặp nhiều
Nitơ (N) hoá trị bao nhiêu ?
I , II, III , IV phần nhiều tới V
Lưu huynh lắm lúc chơi khăm
Khi II lúc IV , VI tăng tột cùng
Clo Iot lung tung
II III V VII thường thì I thôi
Mangan rắc rối nhất đời
Đổi từ I đến VII thời mới yên
Hoá trị II dùng rất nhiều
Hoá trị VII cũng được yêu hay cần
Bài ca hoá trị thuộc lòng
Viết thông công thức đề phòng lãng quên
Học hành cố gắng cần chuyên
Siêng ôn chăm luyện tất nhiên nhớ nhiều
3. Bài ca hóa trị theo chương trình mới
Chlo-rine (Cl), Po-tas-si-um (K)
Hy-dro-gen (H), So-di-um (Na), Sil 0 vẻ (Ag)
Và I-o (d) -dine nữa cơ
Đều cùng hóa trị một (I) nha mọi người
Mag-ne(s)-si-um (Mg), cop-per (Cu)
Ba-ri-um (Ba), Zinc (Zn), Lead (Pb), Mer-cu-ry (Hg)
Cal-ci-um (Ca), O-xy-gen (O)
Hóa trị hai (II) ấy có phần dễ hơn
Bác a-lu-mi-ni-um (Al)
Hóa trị là (III) ghi tâm khắc cốt
Car-bon (C) và Si-li-con (Si)
Là hóa trị bốn (IV) khi cần chớ quên
Ni-tro-gen (N) rắc rối hơn
Một hai ba bốn (I, II, III, IV) khi thì năm (V)
Sul -fur (S) lắm lúc chơi khăm
Lúc hai (II), lúc sáu (VI) khi nằm thứ tư (IV)
Phos-pho-rus (P) nhắc không dư
4. Bài ca nguyên tử khối
Hidro là 1
12 cột Các bon
Nito 14 tròn
Oxi trăng 16
Natri hay láu táu
Nhảy tót lên 23
Khiến Magie gần nhà
Ngậm ngùi nhận 24
27 Nhôm la lớn
Lưu huỳnh giành 32
Khác người thật là tài
Clo ba nhăm rưỡi(35,5)
Kali thích 39
Canxi tiếp 40
Năm nhăm Mangan cười
Sắt đây rùi:56
64 đồng nổi cáu
Bởi kém kẽm (Zn) 65
80 Brom nằm
Xa Bạc (Ag) 108
Bải buồn chán ngán
(137) Một ba bẩy ích chi
kém người ta còn gì!
Thủy ngân (Hg) hai linh mốt(201)
IV, Những nguyên tắc cần nhớ khi học Cấu tạo của bảng nguyên tố tuần hoàn là gì?
-
Trình bày lịch sử phát minh Định luật tuần hoàn và sự ra đời của Bảng tuần hoàn các nguyên tố hóa học.
-
Mô tả cấu trúc của Bảng tuần hoàn các nguyên tố hóa học và giải thích các khái niệm liên quan như ô nguyên tố, chu kỳ và nhóm nguyên tố.
-
Nêu nguyên tắc sắp xếp các nguyên tố trong Bảng tuần hoàn dựa trên cấu hình electron.
-
Phân loại các nguyên tố hóa học theo cấu hình electron (nguyên tố s, p, d, f) và theo tính chất hóa học (kim loại, phi kim, khí hiếm).